【编者按】在上海市科学技术委员会资助(项目编号:22DZ2304300)下,澎湃新闻联合《世界科学》对获得国家及上海市科技奖励的成果进行科普化报道。
本文围绕2021年上海市科技进步一等奖项目“肠道菌群疾病分类模型创建及菌群移植治疗的临床应用”展开,该奖项由同济大学附属第十人民医院秦环龙教授领衔获得。
随着社会老龄化加剧、年轻人工作压力增大,人们罹患的肠道疾病种类和难治程度正发生着巨大改变:药物干预性肠道病变增多,慢病合并消化道病变显著增加,70岁以上老年人合并消化道病变比例高达32%,肠道外病变如阿尔茨海默病、帕金森病、抑郁症合并便秘达90%。新的“不治之症”,如自闭症、炎症性肠病等在肠道疾病中的比例越来越高。然而不幸的是,传统的药物治疗方案没有迅速适应现代化社会肠道疾病谱的改变,出现大量难治性的患者。并且由于抗生素等现代化药物的使用,新的肠道疾病(如免疫治疗相关肠炎等)陆续出现。因此亟需寻找安全、有效、可负担、易实施的新型治疗方案。
肠菌理论引领21世纪医疗技术变革
早在公元前3世纪,现代医学之父希波克拉底就提出“万病始于肠”的科学理念。最新研究表明,绝大部分慢性疾病,包括便秘、腹泻、肥胖、抑郁、脂肪肝、自闭症、心血管疾病、阿尔茨海默病等,都伴随着肠道菌群的失调。肠道菌群通过参与宿主的饮食代谢,产生多种调控分子,如短链脂肪酸、胆汁酸、激素等,调控人体各个脏器,影响宿主营养吸收、免疫响应、脂肪存储、大脑兴奋性、血糖水平等。当人体肠黏膜屏障缺损时,肠道菌群还可以直接易位到远隔脏器引起局部炎症,并且参与肠道肿瘤的远端转移。因此,挖掘肠道菌群与疾病的本质联系,通过修复肠道菌群健康稳态来改善疾病症状,已成为21世纪临床治疗的颠覆性策略。
事实上,早在我国古代东晋时期,葛洪所著的《肘后备急方》中便已有肠道菌群治疗伤寒的详细描述,即“若已六七日热极,心下烦闷,狂言见鬼,欲起走:绞粪汁,饮数合至一二升,谓之黄龙汤,陈久者佳”。但是现代医学靶向肠道菌群大规模治疗疾病的临床实践则起于最近十年,这种疗法被称为“肠菌移植”( FMT),是将健康人粪便中的功能菌群经一定的方式移植到患者肠道内,从而调控肠道微生态平衡、重建肠道菌群,达到预防和治疗肠道内外疾病的目的。目前该疗法已应用于超过80种疾病的临床治疗,尤其是对一些传统治疗方案无效的患者可以发挥奇效(如复发性艰难梭菌感染等),是一项安全有效的新技术。
上海市第十人民医院从2012年便开始进行FMT治疗探索,目前已累计治疗超过2万例患者,在国际上首次提出FMT疗法的响应规律:急性肠道炎症优于肠道慢性炎症,肠道功能性疾病优于肠道器质性疾病,肠道疾病优于肠外疾病,具有肠道症状的肠外疾病优于没有肠道症状的肠外疾病。具体来说,FMT治疗复发性艰难梭菌感染,有效率可以超过90%;治疗便秘和肠易激综合征等肠道功能性疾病,有效率可达65%左右;治疗炎症性肠病等器质性疾病,有效率约为58.4%;治疗帕金森病等伴有肠道症状的肠外疾病,有效率约为48.3%;治疗没有肠道症状的肠外疾病,有效率仅为40.4%。通过对8547名患者进行5年随访,证实FMT不良反应多为短期的、自限性的,主要是腹泻、恶心呕吐、因鼻肠管放置引起的不适症状。因此,FMT是一种安全、有效的“绿色”治疗方案,并且其应用领域在世界范围内迅速拓展,正在引领21世纪医疗理念和诊疗技术的变革。
揭开肠菌移植疗法的神秘面纱
FMT疗法由供体、受体、治疗方案三部分构成,其中有效供体的筛选是决定FMT成败的关键因素。目前国际上对于FMT供体的筛选经过了三个阶段的理念革新:最初阶段,FMT供体筛选标准只有疾病史和用药史;第二阶段,在上述基础上进一步增加了生活史的筛选;第三阶段,进一步增加个人史和血液/粪便的实验室检测。我国作为FMT发源地,对于供体的筛选标准遵循“五步六维度”的规则,比国际标准更为严格和规范,需要综合性考虑供体的心理、生理、个人史、稳定性、持续性、食物耐受性,共6个方面的健康状态。按照目前国际标准,只考虑年龄、身体质量指数(BMI)、疾病史、用药史等因素,FMT应用的有效率只有42.8%,不良事件发生率高达30.7%,甚至包含严重的死亡事件。但是严格遵守“五步六维度”筛选规则,FMT有效率可以提升至68.7%,不良事件发生率可以降低至20.1%,且只有轻度到中度的自限性症状。这些健康供体是健康菌群的重要来源,对于患者失调菌群的矫正至关重要。
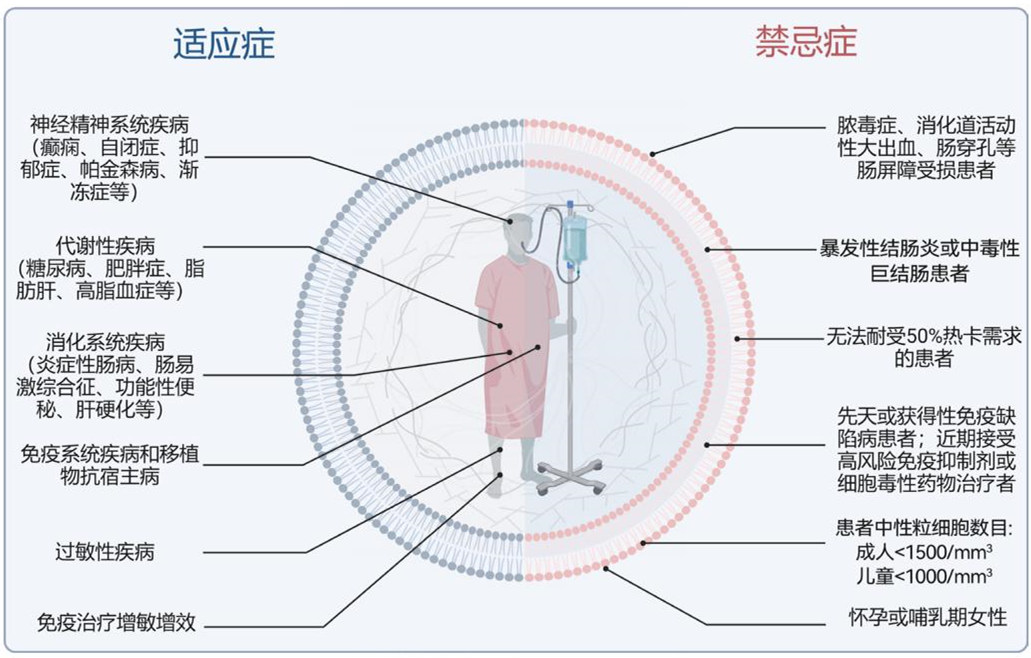
那么,哪些疾病人群可以通过FMT恢复肠道稳态并且改善疾病症状呢?目前,临床指南及专家共识推荐FMT治疗复发性或难治性艰难梭菌感染。除此之外,在消化系统疾病(如炎症性肠病、肠易激综合征、功能性便秘、肝硬化等),神经精神系统疾病(如癫痫、自闭症、抑郁症、帕金森病、肌萎缩侧索硬化症等),代谢性疾病(如糖尿病、肥胖症、脂肪肝、高脂血症等),免疫系统疾病,过敏性疾病以及移植物抗宿主病等,FMT疗法均显示出较好的响应性。此外,FMT还可以作为肿瘤免疫治疗的增敏增效剂,提高患者对免疫检查点抑制剂疗法的治疗响应。
但是,需要特别注意的是,FMT疗法并不适用于所有患者情况,当存在以下禁忌证时,极不推荐盲目使用FMT疗法:(1)伴有脓毒症、消化道活动性大出血、肠穿孔等肠屏障严重受损的患者;(2)暴发性结肠炎或中毒性巨结肠患者;(3)因存在严重腹泻、显著纤维性肠腔狭窄、严重消化道出血、高流量肠瘘等原因无法耐受50%热卡需求的患者;(4)先天或获得性免疫缺陷病患者;(5)近期接受高风险免疫抑制或细胞毒性药物治疗者;(6)成人中性粒细胞<1500/mm3或儿童中性粒细胞<1000/mm3的患者;(7)怀孕或哺乳期女性。
明确了供体和受体特征,接下来如何将健康供体的菌群移植给患者呢?目前国际上主要的移植途径有4种:鼻肠管途径、口服途径、肠镜途径、灌肠途径。对于营养不良的患者,或者病变同时累及小肠和大肠的患者,首推鼻肠管途径。对于不能耐受鼻肠管的患者,例如老人和儿童,推荐使用口服胶囊进行FMT治疗。对于病灶局限于结肠并且FMT单次疗效较好的患者,推荐使用结肠镜FMT。对于病灶局限于直肠或乙状结肠的患者,推荐灌肠FMT。通常情况下,推荐住院患者选择鼻肠管途径进行FMT治疗,巩固治疗的患者通过口服胶囊进行FMT治疗。
现代化工艺推进FMT疗法标准化发展
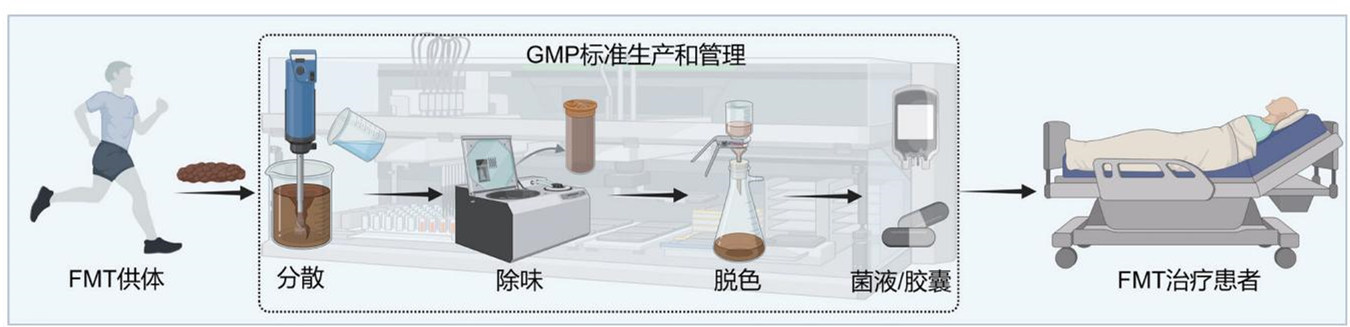
FMT主要通过菌液或其冻干后封装的胶囊进行移植,而现代化工艺可以让这些移植物的生产制备更加标准化和规范化。
用于FMT移植的健康菌群采用可溯源的新鲜粪便制备,由供体在特制的马桶上采集,以确保菌量、活性、菌群来源的可塑性,并且避免尿液和污水的污染。随后,样本迅速冷却至4℃送至符合药品生产质量管理规范(GMP)标准的生产车间,6小时内完成肠道菌群提取,过程中严格保持厌氧环境以确保菌群的活性。
健康菌群的提取采用全自动智能肠菌分离设备。将不少于100克的粪便与生理盐水混合加入该设备,实现全过程的自动搅拌、过滤、分离。整个处理过程均是在密闭控制单元内完成,从而避免外源性细菌污染,最终生成符合治疗要求的菌液。每批次菌液都随机抽取5%进行冻存留样,用作治疗后的追溯。
制备的菌液经4℃离心,加入脱脂奶粉联合甘油作为冻干保护剂,利用冻干技术从菌液中提取活性菌粉,采用耐酸羟丙甲纤维素胶囊进行封装,确保活性菌群可以在肠道释放,避免胃酸对其破坏。
每次制备的菌液和胶囊在FMT应用前均随机抽样进行致病菌检测、活菌计数、微生物基因组测序分析,确保移植物中艰难梭菌、弯曲菌、沙门菌、志贺菌、产志贺毒素大肠杆菌及虫卵、囊泡、寄生虫、孢子、诺如病毒、轮状病毒和新冠病毒等病原学检测阴性,多重耐药基因检测阴性。移植所用菌液的细菌活性不低于80%,并且活菌数不低于5×108个/毫升;胶囊封装的细菌活性不低于70%,并且活菌数不低于1×109个/克。
上述标准化的FMT移植物制备流程均已被写入《肠道菌群移植临床应用管理中国专家共识(2022版)》和《上海市菌群移植技术管理规范(2021年版)》,帮助FMT技术在国内安全、高效、便捷、可控地推广应用。
定植拮抗是FMT应用的“瓶颈”问题
肠道菌群被誉为人体的“隐藏器官”,因此肠菌移植技术在一定程度上可以视为“器官移植”,不可避免地伴有定植拮抗的问题,因此如何精准地将健康菌群移植给所适用的患者是当前FMT临床应用的重要技术难题。
微生态学研究结果表明,肠道微生态群落的初始形成和干预后的恢复力强弱都取决于菌株定植于肠道的先后顺序。也就是说,患者肠道的已有菌群(也叫做原籍菌)会通过多种途径抑制供体的健康菌群在受体肠道内定植。当前FMT疗法的菌株定植率为50%~80%,并且随着疾病的复杂程度升高、微生态失调程度加剧,供体健康菌群的定植效率显著降低。
原籍菌影响供体菌定植的主要机制是生态位抢占,表现为原籍菌和供体健康菌在肠道营养和生存空间上的竞争。在FMT治疗之前,患者的原籍菌便已经在肠道生态位中建立优势地位,特别是其可以优先占据黏液层中的黏蛋白附着位点,并利用其上的唾液酸修饰基团作为碳源进行生长;而新移植的健康菌群无法第一时间获得这些附着位点,导致移植菌群只能停留在肠腔,并且随着肠蠕动逐渐排出体外。需要特别强调的是,抗生素治疗并不是非常推荐的去除原籍菌的方法,一方面是因为这种治疗方案对于黏膜菌群并不敏感,另一方面是其可以显著破坏“肠道食物链”,导致双歧杆菌等“初级生产者”不可逆地减少,进而导致移植的健康菌群因缺少“食物”而更加难以定植。
除了生态位的抢占机制外,患者原籍菌还可以通过改变肠道微环境来阻止供体移植菌的定植,这种机制被称为生态位抑制。与生态位抢占不同,生态位抑制主要通过原籍菌诱导的宿主免疫响应驱动。例如,产短链脂肪酸菌可以通过刺激肠上皮细胞释放抗菌肽,降低移植菌群的活力并抵制其定植。此外,原籍菌还可以直接下场,通过细菌间相互作用直接杀死移植菌群。例如,条件致病菌粪肠球菌可以分泌肠毒素选择性地杀死邻近的乳杆菌。
幸运的是,随着临床大队列的研究,肠道菌群之间的定植拮抗规律逐渐被揭开。目前比较公认的两条规则是:“远亲近斥”和“全有或全无”。“远亲近斥”规则体现的是,遗传发育距离相近的菌株拥有极为相似的营养和空间,因此优先占据生态位的原籍菌会排斥移植的健康菌;而遗传发育距离较远的菌株,倾向于占据“肠道食物链”的不同环节,因此更有机会获得定植优势。“全有或全无”规则体现的是,定植拮抗以菌种为单位进行,如果来源于供体的某个菌株可以定植,那么该菌株的相同种水平菌株都可以在患者肠道内定植;反之,若该菌株无法在患者肠道定植,其相同种水平的菌株都无法定植。这些规律的发现为大数据模型的开发奠定了理论基础,通过先进的供体-受体匹配算法可以精准地为疾病患者找到合适的健康菌群,提高健康菌群在患者肠道内的定植率,进而改善疾病症状。
大数据平台辅助FMT精准应用
为了实现FMT供体和受体的精准匹配,我们建立了FMTdb数据库(gift2disease.net/FMTdb/),收录了数千例患者FMT治疗前后的临床特征和肠道菌群微生物组学测序数据,以及近万例健康人群和各类疾病人群的肠道菌群数据。通过最新的宏基因组学分析算法,可以实现菌群数据的株水平注释,有助于解析各类疾病患者区别于健康人的菌群失调模式。基于该算法,我们已经成功建立18种疾病的肠道菌群分类模型。这些分类指征可以作为FMT预后响应的关键指标用于供体-受体的精准配型。
FMT供体-受体的精准配型可以通过两种机器学习模型实现,一种是基于大型临床队列开发的随机森林模型,另一种是基于FMT预后相关因子开发的层次分析决策模型。随机森林模型的优势是可以根据原籍菌对移植菌的定植拮抗规律预测患者接受FMT治疗后的菌群组成和丰度,然后根据预测结果确定FMT后“健康菌”和“疾病菌”的稳态指数,稳态指数越高表示菌群健康程度越高,进而用于选定最优供体。层次分析决策模型则是利用FMT预后正相关的因子作为决策参考,对所有移植菌群与患者的匹配度进行打分,从而快速找到患者最适宜的健康菌群。
在大数据平台的辅助下,部分疾病的FMT疗法供体-受体的匹配成功率可以高达90%,并且随着数据库所收录病例数的增加,全新的FMT治疗响应规律以及菌群分子分型结果将陆续提出,最终提升FMT在各类疾病中的总有效率。
FMT疗法的发展新机遇
肠道菌群是人类唯一可以共享的“器官”,随着微生态理论和技术的不断革新,FMT将在新时代肠内和肠外疾病治疗中发挥越来越重要的作用。尽管目前国内外的临床研究已经取得了众多卓越成就,但在智能医疗的大背景下,仍然存在一些技术难题需要持续攻坚,从而使FMT疗法更加精准化、规范化、科学化。
目前FMT移植物主要有菌液和冻干菌粉两种,在FMT应用中均已报道呕吐等不良事件,因此在移植物生产工艺改进中需要高效的脱色和除味步骤。并且,现有FMT产品在体积和移植途径方面对于婴幼儿患者群体并不友好。为了应对这些挑战,需要开发尺寸更小且不影响菌群活性的新FMT产品。在这方面,3D打印技术似乎是一个可行的解决方案,它可以制备更小、更可控的FMT滴丸或胶囊,有助于提高FMT的适用性。此外,复合细菌或孢子成分的掺入也将是一种极具价值的改进,可以从根本上提高FMT移植物的可控性和批间一致性,从而为患者提供更有针对性和更有效的干预。
FMT个性化治疗方案的有效性在不同个体间存在显著异质性,这表明存在与各种病理和疾病特征相关的普适性生态失调特征。利用更高分辨率的分析方法和定量检测技术可以识别这些独特的特征。在此基础上,深入解析菌群相互作用,绘制完整的原籍菌定植拮抗网络,结合改进的移植物制备体系,有望实现对特定患者的个性化菌群精准干预。
工程菌和噬菌体的FMT应用针对定植拮抗问题,一个可行的解决方案是分离、培养和定向改造患者的肠道菌群,通过类似水平基因转移等菌群互作的常规途径,赋予患者肠道菌群独特的生物学功能,从而起到治疗疾病的作用。由于分离的菌群来自患者自身,因此这种工程菌几乎不会面临定植拮抗的问题,它可以作为“特洛伊木马”精确修复肠道微环境,从而为供体细菌提供更多的定植生态位。同样,噬菌体疗法也是以占据生态位的患者原籍菌为靶点,在FMT前特异性地消除阻碍供体细菌定植的因素,最终改善供体健康微生物在患者肠道中的定植效率。
结 语
21世纪是肠道微生物组的时代。深入了解肠道菌群稳态失调与各类肠内和肠外疾病的因果关系,开展大队列、多病种、纵向时间序列临床研究,开发精准化、个性化、规范化治疗方案,将成为改善人民健康水平的重要策略,助力“健康中国2030”伟业实施。








还没有评论,来说两句吧...